As pilhas são geradores químicos, elas transformam energia potencial química em energia elétrica através de um fluxo de elétrons promovido por uma reação de oxirredução espontânea, a corrente gerada é contínua (uma corrente elétrica que não altera o sentido do seu fluxo de elétrons no decorrer do tempo). Lembrando que corrente elétrica é um fluxo ordenado de elétrons que parte do polo negativo do gerador e vai até o polo positivo!
Em 1836, o químico e meteorologista nascido em Londres John Frederic Daniell (1790 - 1845) criou uma pilha que levou o seu nome.
A pilha de Daniell é composta por duas semicelas ou semicélulas eletroquímicas:
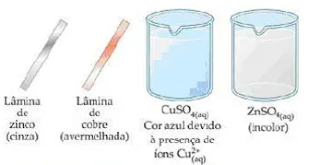
- A primeira semicela: uma lâmina de cobre (avermelhada) mergulhada em uma solução de sulfato de cobre (II) (CuSO4), de cor azul;
- A segunda semicela: uma lâmina de zinco (cinza) mergulhada em uma solução de sulfato de zinco (ZnSO₄), incolor;
- As duas lâminas são interligadas por um fio condutor de cobre, com uma lâmpada, que quando ligada, indicaria a passagem da corrente elétrica. Também podemos realizar esse experimento com um voltímetro no lugar da lâmpada, ele indicaria a voltagem,
- As duas soluções são interligadas por um tubo em U que contém uma solução aquosa concentrada de um sal bastante solúvel. Geralmente, as soluções usadas são de cloreto de potássio (KCl(aq)), nitrato de amônio (NH4NO3(aq)), nitrato de sódio (NaNO3(aq)) ou nitrato de potássio (KNO3(aq)). As extremidades do tubo são fechadas por algum material poroso, como algodão ou ágar-ágar. Essa é a ponte salina.
*As duas lâminas são eletrodos: uma superfície sólida condutora utilizada para viabilizar a troca de elétrons mediante corrente elétrica.
*Eletrodo + solução = semicela/semicélula eletroquímica.
Após a montagem a pilha fica com esse aspecto:
Depois de certo tempo de funcionamento, além da lâmpada estar acesa, a solução de CuSO4 fica mais clara, a placa de zinco diminui de massa, sofre corrosão, e a de cobre aumenta de massa, sofre deposição.
Veja no vídeo abaixo o experimento na prática:
Qual o circuito formado?
Eletrodo de zinco → fio metálico → eletrodo de cobre → solução de sulfato de cobre → solução salina → solução de sulfato de zinco → eletrodo de zinco.
Nos condutores metálicos o fluxo de elétrons é organizado, enquanto nas soluções aquosas temos um fluxo desordenado de íons.
Quimicamente, o que ocorre na pilha de Daniell?
No eletrodo de zinco, o ânodo (polo negativo): átomos de zinco metálico oxidam, liberando elétrons e formando íons Zn2+, que se dissolvem na solução. Ocorre, portanto, corrosão do metal contido no eletrodo, que nesse caso pode ser percebido pelo desgaste e diminuição da massa do eletrodo.
* Como mostra a fila de reatividade dos metais, o zinco é mais reativo que o cobre, por isso, tem maior tendência de oxidar-se.
Semirreação do ânodo: Zn( s) ↔ Zn2+(aq) + 2 e-
No eletrodo de cobre, o cátodo (polo positivo): os elétrons liberados no ânodo seguem pelo fio condutor até chegar ao cátodo, eletrodo em que ocorre a redução e polo positivo da pilha. Os íons Cu2+ da solução recebem os elétrons, reduzindo e formando átomos de cobre metálico, que se depositam sobre o eletrodo.
Semirreação do cátodo: Cu2+(aq) + 2 e- ↔ Cu( s)
O resultado de tudo isso: à medida que ocorre a oxidação do zinco metálico, a concentração de íons Zn2+ vai aumentando na solução da semicela de zinco, enquanto na semicela de cobre ocorre a redução dos íons Cu2+, diminuindo sua concentração na solução.
Para que a neutralidade das cargas seja mantida, ocorre uma transferência de íons entre as soluções através da ponte salina: ânions (íons negativos) seguem em direção à semicela em que ocorre a oxidação enquanto cátions (íons positivos) seguem em direção à semicela em que ocorre a redução. Como exemplo, veja a transferência de íons numa ponte salina cuja solução usada é o cloreto de potássio (KCl(aq)):
Notação/representação da pilha:
No caso da pilha de zinco e cobre:
Cálculo da diferença de potencial (ddp) de uma pilha:
*O que é ddp? A tensão elétrica ou diferencial de potencial (ddp), medida em volt (V) no Sistema Internacional de Unidades, está associada à capacidade de um gerador de fornecer energia elétrica a um aparelho. As reações que ocorrem no interior de um gerador eletroquímico, por exemplo, fazem que cargas elétricas de sinais opostos se acumulem em cada um dos polos da pilha. Devido à interação elétrica (atração e repulsão; princípio de Du Fay), as cargas elétricas possuirão energia potencial (acumulada), sendo o potencial elétrico a grandeza que relaciona cargas e a energia elétrica. Quando o circuito é fechado, essas cargas são submetidas a uma diferença de potencial, colocando-as em movimento e deslocando-as de um polo a outro.
A ddp é uma grandeza física que mede a capacidade que um gerador de corrente elétrica tem para impulsionar elétrons através do circuito.
O voltímetro é o instrumento usado para medir a voltagem/a tensão/a ddp.
A voltagem da ddp produzida em uma pilha depende do potencial que os eletrodos possuem. Todo eletrodo apresenta uma capacidade de oxidar ou reduzir, assim, se ele oxida, é porque seu potencial de oxidação superou o do outro eletrodo ou vice-versa.
A ddp está relacionada com a tendência de oxidação do agente redutor e a tendência de redução do agente oxidante, de modo que, quanto maior for a ddp de uma pilha, maior será a tendência de que a reação de transferência de elétrons ocorra.
A diferença de potencial de um gerador de corrente elétrica é calculada por meio da fórmula:
U = E - r . i
U: ddp; E: força eletromotriz (fem); r: resistência interna do gerador; i: intensidade da corrente elétrica.
*O maior valor para a ddp de uma pilha, que é o valor no início de seu funcionamento, é chamado de força eletromotriz (fem ou E).
Com base nessa equação, podemos afirmar que a força eletromotriz se iguala à ddp quando não há passagem de corrente (i = 0) ou quando a resistência interna for nula (r = 0). Um gerador é chamado de ideal quando essas duas variáveis são nulas. Em Química, consideramos as pilhas geradores ideais; portanto, podemos assumir que U = E.
A ddp de uma pilha depende das espécies químicas envolvidas na reação de oxirredução, da concentração das soluções utilizadas e da temperatura em que o sistema se encontra.
- Concentração: No início do funcionamento da pilha, a concentração de íons na solução é maior e, por isso, a capacidade da outra espécie química de doar elétrons é a máxima. Mas, com o tempo, a concentração desses íons vai diminuindo e a ddp diminui gradativamente;
- Temperatura: A elevação da temperatura aumenta a velocidade das reações, provocando variações na ddp da pilha.
Por esse motivo, a ddp é medida em condições-padrão (25 °C, 105 Pa, 1 mol/L)
Devido a isso, decidiu-se determinar um potencial-padrão (ou normal, em 25°C, pressão de 1atm, e concentração de 1,0 mol/L) que é identificado pelo símbolo E0. A diferença de potencial de uma pilha nessas condições é representada por ΔE0.
O é numericamente igual à diferença entre o potencial-padrão de redução da semicela em que ocorre a redução e o da semicela em que ocorre a oxidação. Assim:
ΔE0 = E0red cátodo/maior - E0 red ânodo/menor
Os potenciais de redução e de oxidação de um elemento são numericamente iguais, apenas com o sinal oposto. Por exemplo, o potencial de redução do cobre, é + 0,34, e seu potencial de oxidação é igual a – 0,34.
O ΔE0 de uma pilha será maior quanto maior for o potencial de redução do cátodo e maior o potencial de oxidação do ânodo.
Vamos considerar uma pilha formada por eletrodos de zinco e cobre, cujos E0 são:
Zn2+(aq) + 2 e- ↔ Zn( s) Ered = - 0,76 V
Cu2+(aq) + 2 e- ↔ Cu( s) Ered = + 0,34 V (maior potencial: reduz; cátodo)
ΔE0 = E0red cátodo - E0 red ânodo
ΔE0 = Ered Cu2+ - Ered Zn2+
ΔE0 = + 0,34 – (- 0,76)
ΔE0 = + 1,10 V
ΔE0 = Ered Cu2+ - Ered Zn2+
ΔE0 = + 0,34 – (- 0,76)
ΔE0 = + 1,10 V
Eu posso fazer uma pilha com outros metais, sem ser zinco ou cobre?
Sim, mas o sentido do fluxo dos elétrons dependerá de qual metal estará no eletrodo, pois cada metal possui um potencial de redução e de oxidação. Numa pilha, sempre a espécie que apresenta o maior potencial de redução sofrerá a redução e, portanto, a outra espécie que possui maior potencial de oxidação, sofrerá a oxidação.
Na pilha de zinco e cobre, o zinco tem maior potencial de oxidação que o cobre e, consequentemente, o zinco tem menor potencial de redução que o cobre:
Eoxi Cu2+ < Eoxi Zn 2+
Ered Cu2+ > Ered Zn2+
Resumo:
(Clique na imagem para aumentá-la)
Fontes Kuadro, Alunos Online, Manual da Química, Mundo Educação.








Nenhum comentário:
Postar um comentário